Сьогодні у медичній практиці великого значення набуває непряма ультразвукова еластографія печінки, яка з високою достовірністю верификує зміни структури печінки як при первинному обстеженні, так і в подальшому спостереженні. У статті обговорені можливості real-time еластографії, її переваги перед іншими методиками у визначенні фіброзу та диференціюванні осередкових утворень. Наведені клінічні приклади, що розкривають діагностичне значення real-time еластографії.
Ключевые слова
Печінка, фіброз, осередкові утворення, диференціювання, real-time еластографія.
В настоящее время особую актуальность приобретает совершенствование методов диагностики фиброза печени (ФП), а также дифференцирование очаговых образований ее ткани. Введение полвека назад в клиническую практику пункционной биопсии печени с последующим гистологическим изучением полученного образца впервые позволило прижизненно оценить морфологическое состояние органа. И сегодня это исследование принято считать золотым стандартом диагностики заболеваний печени различного генеза. Вместе с тем, пункционная биопсия печени является инвазивным методом, сопряженным с определенными трудностями, особенно в случаях повторного проведения, связана с рядом неблагоприятных событий со стороны пациента [1], сложностями отбора пациентов для процедуры и ошибками в ее исполнении [2, 3], различными подходами специалистов-гистологов в интерпретации полученных данных [4].
Однако выявление ФП на ранних стадиях, уточнение характера очагового образования, определение особенностей течения процессов играет решающую роль для стратификации диагноза, объема лечения и структурирования представлений о прогнозе хронических болезней печени вне зависимости от их этиологии. Для решения задачи оценки плотности ткани печени в количественном эквиваленте (кПа) в начале 2000 гг. была разработана непрямая ультразвуковая эластометрия с использованием аппарата Fibroscan французской фирмы Echosens, именуемая в специальной литературе «transient еlastography» (ТЕ). ТЕ является узкоспециализированной методикой и используется только для оценки выраженности ФП.
На основании многолетнего опыта использования ТЕ сделаны следующие выводы (подробно изложены в докладе на ресурсе www.elsevier.ru/WNH). ТЕ на аппарате Fibroscan, по-видимому, позволяет получить объективную оценку при значительном ФП. При отсутствии такового результаты могут значительно искажаться за счет сопутствующих факторов, а именно: воспаления, тканевого отека, холестаза, застойной гиперемии, гипербилирубинемии. Результаты ТЕ существенно зависят от индекса массы тела и степени гепатостеатоза. Интерпретация ТЕ на аппарате Fibroscan не может применяться в отрыве от использования доплерографии портальной системы с изучением градиента давления в ее различных отделах. Экстраполируя диагностические возможности данного метода, большинство зарубежных авторов указывают на адекватные показатели метода в границах F2-F3 по шкале Metavir.
Метод неинвазивной оценки плотности ткани печени продолжил свое развитие путем объединения возможности визуализации в серошкальном В-режиме и цветового картирования участков ткани различной плотности. Методика реализована в синхронном выполнении этих режимов: исследователь в В-режиме видит обычную ультра-звуковую картину зоны интереса и параллельно в режиме эластографии может оценить плотность этой зоны в режиме цветового картирования. При этом различают два вида эластографии: эластографию сдвиговой волны (acoustic radiation force impulse (ARFI) – акустическая импульсно-волновая эластография [5], и статическую, реализуемую путем простой компрессии датчика, или, как принято ее обозначать в зарубежной литературе, real-time elastography (RTE) – real-time эластография.
Развитием методики ARFI заняты европейские производители ультразвукового оборудования (Siemens, SuperSonix). Методике RTE отдают предпочтение ведущие производители ультразвукового оборудования США и Японии (Hitachi, Toshiba, Ultrasonix, GE). Принципиальным отличием методик ARFI, RTE и ТЕ является использование двумя первыми прямой визуализации предмета исследования. Этого лишена методика ТЕ, выполняющаяся путем «слепого» наведениея сигнала. Кроме того, и ARFI, и RTE позволяют изучать не только диффузные поражения печени, но и с успехом решать вопросы ее очаговой патологии, а также других органов брюшной полости (поджелудочной железы и почек, надпочечников, органов малого таза).
Применение RTE для исследования эластических свойств глубоко расположенных органов является относительно новым. Что касается печени, принцип RTE обосновывается с позиции физической «модели пружины» [6]. Доказано, что измерять жесткость печени возможно без компрессии датчиком. Это обусловлено тем, что печень, как и другие внутренние органы, сама по себе подвергается ритмичным компрессионным воздействиям вследствие сократительной работы сердца и передаточной пульсовой волны в крупных артериальных сосудах. Отраженные эхо-сигналы используются для вычисления перемещения участка ткани печени, и, таким образом, распределения деформации.
Выполняя методику RTE, сканер отображает цветовую кодировку эластографии, наложенную на B-режим изображения в реальном времени. При этом плотностные качества ткани печени оцениваются одновременно двумя параметрами: самой цветовой кодировкой, оцениваемой по шкале Tsukuba Elasticity Score pattern и количественными расчетными показателями относительной жесткости ткани – elastic stran ratio (ЕSR), которые выполняются исследователем во множестве точек, так называемых «зонах интереса» – region of interest (ROI).
Коэффициент упругости (ЕSR) является отношением распределения деформации в двух выбранных ROI: участка паренхимы печени и расположенной рядом контрольной точки, как правило, участка печеночной вены. Референтные значения печеночных вен выбраны потому, что их эластичность не меняется с возрастом. Печеночные вены также не подвержены трансформациям, связанным с повышением или понижением плотности стенки, например, при артериосклерозе, и на всем протяжении болезни печени, даже при фибротической трансформации ее паренхимы [6]. По результатам исследования высчитывается наиболее важный для врача-клинициста показатель среднего значения – ЕSR mean. На данный показатель врач ориентируется, проводя лечение больного с хроническим заболеванием печени.
По мнению зарубежных ученых, методика RTE легко воспроизводима, не зависит от ограничений по состоянию пациентов, как ТЕ, и что наиболее ценно – показатели RTE имеют четкую корреляцию с морфологическими стадиями шкалы Metavir.
Согласно общепринятой шкале Metavir, проводится следующая морфологическая оценка стадии ФП. Стадия F0 – отсутствие фиброза, F1 – расширение портальных трактов без формирования септ, F2 – портальный фиброз в сочетании с единичными септами, F3 – портальный фиброз в сочетании с множественными септами без ложных долек, F4 – цирроз печени. Повышение уровня ЕSR позитивно коррелирует с повышением плотности печени по данным пункционной биопсии (r = 0.82, р = 0,001), и соотносится с распределением стадий фиброза по шкале Метаvir. Результаты соответствия данных RTE и степени фиброза по шкале Метаvir выглядят следующим образом:
F1 – среднее значение 2,21 (диапазон 1,94-2,70);
F2 – среднее значение 2,69 (диапазон 2,29-2,97);
F3 – среднее значение 3,42 (диапазон 3,07 - 3,65);
и F4 – среднее значение 4,66 (диапазон: 4,40-4,93).
Также данные, полученные с помощью ЕSR, коррелируют с данными оценки фиброза с помощью исследований показателей гиалуроновой кислоты, коллагена IV типа, APRI – индекса (aspartate aminotransferase–to–platelet ratio index), FibroIndex, лабораторных методик Forns score и Hepascore соответственно: 0,95, 0,32, 0,73, 0,76, 0,76, 0,87 и 0,70. При этом, оценка стадии фиброза F1 методом RTE выявила большую чувствительность по сравнению с серологическим методом [6].
В случае выявления в В-режиме очагового поражения печени врач-сонолог с помощью RTE оценивает очаг с позиции «доброкачественное/злокачественное образование», проводит предположительную оценку гистоструктуры очага и определяет область биопсии при наличии показаний. Это связано с тем, что высокая плотность или жесткость новообразования является показателем его злокачественности. Такая дополнительная диагностическая возможность RTE также выгодно отличает ее от ТЕ (фибросканирования).
Таким образом, методика RTE дает четкую оценку степени фиброза/цирроза печени по шкале Метаvir. Принципиально важным является определение ранних стадий заболевания, а также фиксирование показателя среднего значения «ESR mean», изменения которого при последующих исследованиях дает возможность оценить положительную или отрицательную динамику состояния паренхимы печени, а также оценить эффективность проводимого лечения.
Ниже приводим описание нескольких клинических случаев собственных наблюдений. RTE печени проведено по стандартной методике [7] на ультразвуковом сканере Premium-класса Ultrasonix Touch, канадской компании Ultrasonix (e-mail: doctrina@ua.fm).
При исследовании наличия ФП и его стадии оценивали индекс упругости (ESR). При выявлении очагов печени наряду с количественным параметром ESR оценивали цветовой паттерн: однородность окраски, распределение по цветовой шкале (в данном аппарате максимальная жесткость представлена красным цветом).
Клинический случай 1. Пациент К., 44 г., 6 лет назад прошел антивирусную терапию (пегинтрон+ребетол) по поводу хронического вирусного гепатита С (HCV), генотип 1b. Показатели общеклинических анализов, печеночного комплекса, данные УЗИ органов брюшной полости – в пределах нормы.
Заключение RTЕ (рис. 1): диапазон колебаний индекса ESR 0-1,5, ESR mean 1,5, что соответствует степени фиброза F0-F1 по шкале Метаvir.
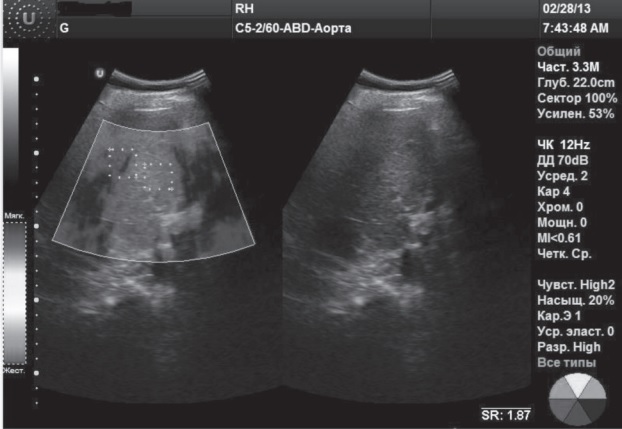
Рис. 1. RTЕ: степень фиброза F0-F1
Итак, показателем полной эрадикация вируса гепатита С, или устойчивого вирусологического ответа, является отсутствие РНК вируса (уровень РНК в крови ниже 50 МЕ/мл) при выполнении полимеразной цепной реакции на 24-й неделе после завершения курса терапии. Достижение устойчивого вирусологического ответа приравнивается к излечению от HCV-инфекции у пациентов с неосложненным гепатитом. Таким образом, поскольку устранен этиологический фактор, после достижения стойкой вирусологической ремиссии поражение печени не прогрессирует, что подтверждено RTЕ.
Клинический случай 2. Женщина, 52 г., с астеническим синдромом многократно обследовалась без установления точного диагноза. Показатели общеклинических анализов, печеночного комплекса в течение нескольких последних лет всегда соответствовали норме. Данные УЗИ органов брюшной полости в динамике без особенностей.
Заключение RTЕ (рис. 2): диапазон колебаний индекса ESR 2,3-2,8, ESR mean 2,47, что соответствует степени фиброза F2-F3 по шкале Метаvir.
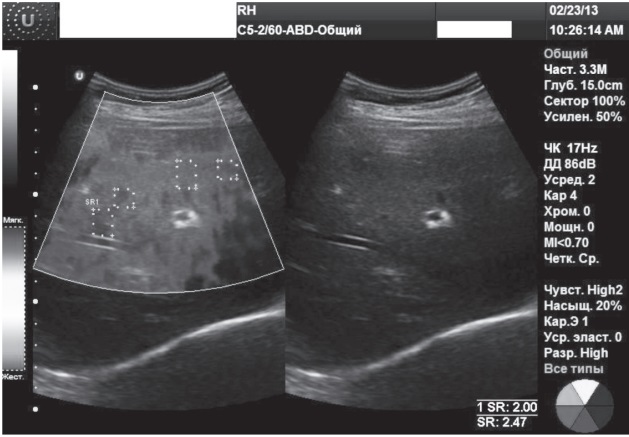
Рис. 2. RTЕ: степень фиброза F2-F3
Направлена на исследование крови по поводу хронических вирусов гепатита. Выявлено наличие РНК – HCV, генотип 1b, вирусная нагрузка 2,1 х 106 копий/мл (7,7 х 105 МЕ/мл).
По мнению экспертов EASL, всех пациентов с компенсированным HCV, ранее не получавших лечения, которые желают лечиться и не имеют противопоказаний, следует рассматривать как кандидатов на противовирусную терапию, независимо от исходного уровня трансфераз (АЛТ). Лечение рекомендовано пациентам с выраженным фиброзом (оценка по шкале Metavir F3-F4) и строго рекомендовано пациентам с умеренным фиброзом (F2 по шкале Metavir).
Таким образом, хронический вирусный гепатит С протекал без изменения лабораторных и ультразвуковых данных. Выявление степени фиброза F2-F3 по шкале Метаvir позволило заподозрить эту инфекцию, назначить целенаправленное исследование, установить диагноз и начать антивирусную терапию.
Клинический случай 3. Женщина, 28 лет, с диагнозом лимфогрануломатоз (локализация лимфоузлов в средостении и печени). Прошла 7 курсов химиотерапии. Состояние стабилизировалось. При УЗИ печени из 6 очагов, выявленных в начале лечения, сохранялся 1, что заставляло выбрать дальнейшую тактику лечения. Четко дифференцировать очаг при УЗИ печени не удавалось.
Заключение по RTЕ (рис.3): выявлено объемное образование размером 12х8 мм в 5-м сегменте, однородным типом цветового картирования с преобладанием паттерна синего цвета (blu-color). ESR образования составил 1,61. Комплексный анализ RTЕ с учетом характера цветового паттерна и индекса жесткости выявленного образования позволили сделать заключение о кавернозной гемангиоме правой доли печени.
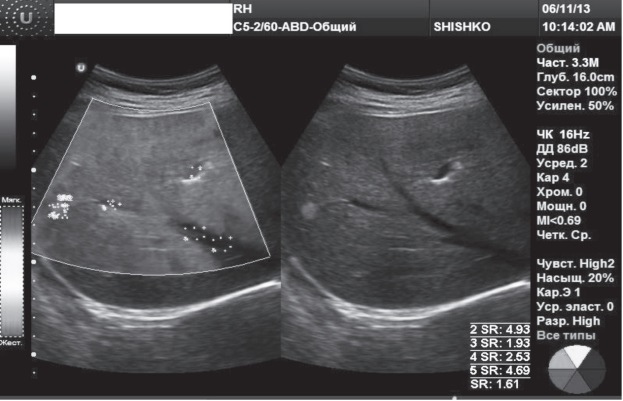
Рис.3. RTЕ очагового образования: гемангиома правой доли печени
Клинический случай 4. Женщина, 46 лет, при УЗИ печени обнаружены множественные очаги, подозрительные на метастатический процесс. При выполнении RTЕ (рис. 4) выявленные очаги характеризовались неоднородным типом цветового картирования с преобладанием красного цвета, индекс ESR в образовании составил 4,15-10,67, что позволило установить злокачественный характер образований и рекомендовать проведение биопсии.
Таким образом, первый опыт использования RTЕ позволяет считать эту методику необходимой в диагностике ФП, определении его стадии и прогнозировании течения заболеваний, особенно при невозможности проведения биопсии. Анализ параметров RTЕ является особенно полезным в динамике наблюдения за пациентами. Проведение дополнительного ультразвукового исследования в режиме RTЕ целесообразно для дифференциальной диагностики очаговых образований печени для точного представления об их характере и планирования дальнейшей врачебной тактики.
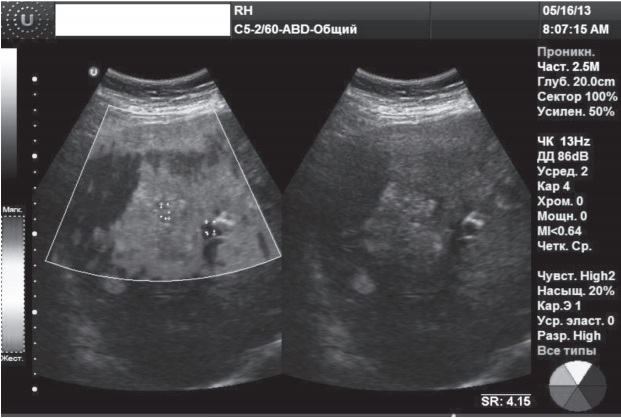
Рис. 4. RTЕ очагового образования: метастазы печени
Список использованной литературы
1. Cadranel J.F., Rufat P., Degos F. Practices of liver biopsy in France: results of a prospective nationwide survey. For the Group of Epidemiology of the French Association for the Study of the Liver (AFEF) . Hepatology 2000; 32 ( 3 ): 477-481 .
2. Pagliaro L., Rinaldi F., Craxì A. et al. Percutaneous blind biopsy versus laparoscopy with guided biopsy in diagnosis of cirrhosis: a prospective, randomized trial . Dig Dis Sci 1983; 28 (1): 39-43.
3. Regev A., Berho M., Jeffers L.J., et al. Sampling error and intraobserver variation in liver biopsy in patients with chronic HCV infection. Am J Gastroenterol 2002; 97 (10): 2614-2618 .
4. Rousselet M.C., Michalak S., Dupré F. et al. Sources of variability in histological scoring of chronic viral hepatitis. Hepatology 2005; 41 (2): 257-264.
5. Rifai K., Cornberg J., Bahr M., Mederacke I., Potthoff A., Wedemeyer H., Manns M., Gebel M. / ARFI elastography of the spleen is inferior to liver elastography for the detection of portal hypertension. / Ultraschall Med. 2011 Dec; 32 Suppl 2:E24-30. doi: 10.1055/s-0031-1281771. Epub 2011 Dec 22.
6. Friedrich-Rust M., Ong M.F., Herrmann E. et al. Real-time elastography for noninvasive assessment of liver fi brosis in chronic viral hepatitis . AJR Am J Roentgenol 2007; 188 (3): 758-764 .
7. Koizumi Y., Hirooka M., Kisaka Y. et al. Liver fibrosis in patients with chronic hepatitis C: noninvasive diagnosis by means of real-time tissue elastography-establishment of the method for measurement. Radiology 2011; 258: 610-617.
FIRST EXPERIENCEOF APPLICATION OF REAL-TIME ELASTOGRAPHY AT THE DISEASES OF LIVER OF DIFFERENT GENESIS
Shcherbinina M.B., Maykova Т.V.
Summary
Тhe large claimed is acquired by an unline ultrasonic a elastography liver, allowing with the high degree of authenticity to verify the change of structure a liver both at a primary inspection and subsequent supervision. Possibilities of real-time elastography are discussed in the article, its advantages before other methods in determination of degree of liver fibrosis and embryonization of hearth educaions. Clinical examples, exposing the diagnostic value of real-time elastography are resulted.